Kita dapat mengenali asam dan basa dari
rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara
mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk
mengidentifikasi asam dan basa yang baik dan aman dapat dengan
menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi
dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
Asam merupakan salah satu penyusun dari
berbagai bahan makanan dan minuman, misalnya cuka, keju, dan
buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan
melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion
hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen.
Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation
adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang
bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat
bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik.
Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi
dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi
(II) klorida (FeCl2).
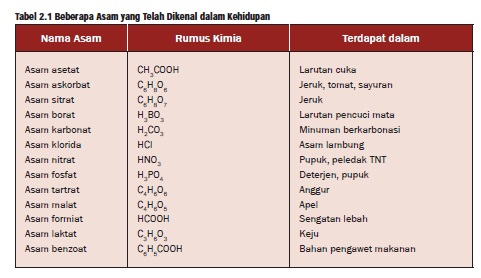
Tabel beberapa contoh asam
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik
umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah,
maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.
2.Basa
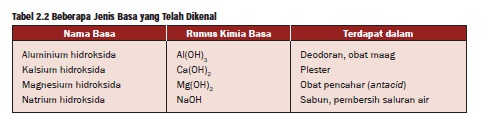
Dalam keadaan murni, basa umumnya berupa
kristal padat dan bersifat kaustik. Beberapa produk rumah tangga seperti
deodoran, obat maag (antacid) dan sabun serta deterjen mengandung basa.
Basa adalah suatu senyawa yang jika
dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-).
Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH.
Jika diketahui rumus kimia suatu basa,
maka untuk memberi nama basa, cukup dengan menyebut nama logam dan
diikuti kata hidroksida.
Tabel beberapa contoh Basa
Perbedaan Sifat Asam dan Basa
3. Garam
Orang mengalami sakit perut disebabkan
asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl)
digunakan antacid. Antacid mengandung basa yang dapat menetralkan
kelebihan asam lambung (HCl).
Umumnya zat-zat dengan sifat yang
berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru.
Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari
asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.



Tidak ada komentar:
Posting Komentar